君实生物食管鳞癌一线获批,PD-1适应症增至五项国金证券2022-05-18.pdf
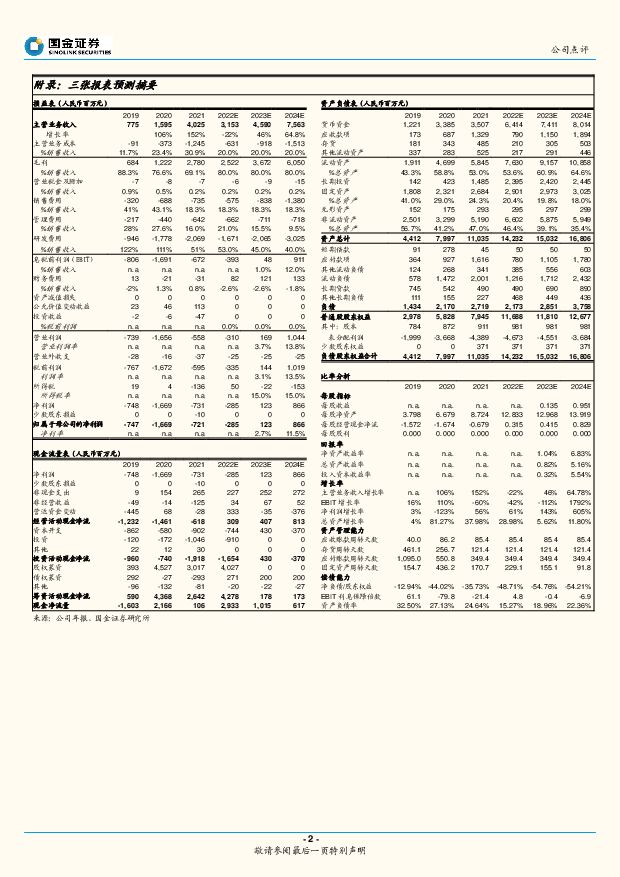

摘要:君实生物(688180)事件2022年5月17日,公司公告,特瑞普利单抗(商品名:拓益®)联合紫杉醇和顺铂用于不可切除局部晚期/复发或远处转移性食管鳞癌患者的一线治疗的新适应症上市申请获得批准。评论特瑞普利单抗适应症新增第五项适应症,食管鳞癌一线治疗患者获益显著。(1)特瑞普利单抗是国产首个获批PD-1,于2018年12月获批首个适应症黑色素瘤,至今仍为国产独家;后接连获批鼻咽癌、尿路上皮癌、食管鳞癌。(2)中国食管癌患者占据全球一半以上,中国每年食管癌新发患者三十多万,其中约90%为食管鳞癌。以铂类为基础的一线化疗在临床上获益有限,5年生存期不足20%,食管鳞癌治疗具有临床未满足的需求。(3)此次获批基于一项特瑞普利单抗联合化疗对比安慰剂联合化疗的三期临床研究JUPITER-06;结果显示,特瑞普利单抗联合化疗组的总生存期(OS)显著改善,中位OS分别为17个月vs11个月,疾病进展或者死亡风险降低42%(HR=0.58);ORR分别为69.3%vs52.1%(p<0.0001)。PD-1赴美延期,期待特瑞普利单抗后续多个催化剂。(1)国内预期催化剂:非小细胞肺癌适应症国内已获受理,预计年内获批;前瞻布局肝癌辅助治疗,预计今年将有临床数据读出。(2)创新出海:公司收到FDA关于特瑞普利单抗鼻咽癌在美BLA的回复信,要求进行一项公司认为较为容易完成的质控流程变更;待完成的现场核查因新型冠状病毒肺炎疫情相关的旅行限制而受阻,公司预计在今年仲夏前重新提交BLA。研发投入持续,定增再添助力。公司拟定增不超过39.8亿用于创新药项目研发和科技总部及研发基地项目,持续提升创新实力。创新管线方面,公司拥有全球原研靶点BTLA项目,一期临床结果将于ASCO2022首次公布;新冠小分子口服药VV116正在开展与Paxlovid做对比的3期临床试验,有望成为中国首个获批紧急使用的国产新冠口服药。盈利预测与投资建议我们维持公司盈利预测,预计公司2022/23/24年销售收入为31.5/45.9/75.6亿元,净利润为-2.85/1.23/8.66亿元。维持“买入”评级。风险提示研发进程、进医保后销量不达预期以及限售股解禁等风险。
免责声明: 1.本站部分作品是由网友自主投稿和发布、编辑整理上传,对此类作品本站仅提供交流平台,不为其版权负责。 2.如发布机构认为违背了您的权益,请与我们联系,我们将对相关资料予以删除。 3.资源付费,仅为我们搜集整理和运营维护费用,感谢您的支持!
合集服务: 单个细分行业的合集获取请联系行研君:hanyanjun830
-
医药生物:系统性红斑狼疮蓝海市场,生物制剂脱颖而出 西南证券 2024-04-23(49页) 附下载

系统性红斑狼疮患者人数多,市场空间大,目前仍存在巨大未满足的临床需求,生物制剂是特应性皮炎治疗的下一...
4.08 MB共49页中文简体
1天前020积分
-
能源周观点:伊朗低调回应袭击,油价风险溢价缩小 国金证券 2024-04-23(14页) 附下载

原油油价展望:伊以冲突强度低于此前市场预期,油价下跌,提前反应了我们上周提到的中期油价回调逻辑,由于...
3.53 MB共14页中文简体
1天前020积分
-
生物医药行业:百年诺华专注创新,小核酸、核药领域布局领先 平安证券 2024-04-23(35页) 附下载

投资要点百年诺华,走向专注。诺华及其前身可追溯到250多年前。自公司成立以来,诺华制药经历过数次经营...
2.99 MB共35页中文简体
1天前020积分
-
医药生物行业周报:看好央国企改革和老龄化需求带来的品牌效益 信达证券 2024-04-23(15页) 附下载

本期内容提要:上周市场表现:上周医药生物板块收益率为-1.56%,板块相对沪深300收益率为-1.3...
1.3 MB共15页中文简体
1天前220积分
-
氢能&燃料电池行业研究:FCV 3月装机量翻倍,将迎持续高增长 国金证券 2024-04-23(14页) 附下载

行业数据点评FCV3月装机量59.54MW,2024Q1装机量达101.90MW。2024年3月,F...
1.86 MB共14页中文简体
1天前120积分
-
医药生物行业报告:医药板块行情分化,关注消费医疗、国产设备机会 中邮证券 2024-04-23(16页) 附下载

一周观点:国产医疗器械竞争力提升,出海大势所趋根据彭博社4月15日消息,欧盟或将对中国医疗器械采购启...
1.05 MB共16页中文简体
1天前220积分
-
电力设备与新能源行业研究:高效太阳能电池系列深度(六):0BB工艺专题:从可选到必选,N型组件降本增效最优解 国金证券 2024-04-23(24页) 附下载

多数环节重大技术变革渐缓,组件环节短期内仍有迭代空间:光伏行业现阶段硅料、硅片、电池环节已基本完成技...
2.51 MB共24页中文简体
1天前220积分
-
公用事业及环保产业行业研究:1-2月用电:制造、消费同比增速领涨 国金证券 2024-04-23(16页) 附下载

总量及分板块视角:1)1-2月全社会用电量15315.8亿千瓦时。一/二/三产用电量均稳步增长;其中...
1.9 MB共16页中文简体
1天前220积分
-
视觉中国 AI赋能主营平台效率,视觉素材价值重估指日可待 国金证券 2024-04-23(23页) 附下载

视觉中国(000681)主营图库业务壁垒高、粘性强,中长尾客户有望持续增长,布局3D或带来增量。1)...
3.1 MB共23页中文简体
1天前218积分
-
微芯生物 公司年报点评:2024,进入微芯原创新药收获之年 海通国际 2024-04-23(12页) 附下载

微芯生物(688321)投资要点:2023年公司业绩表现平平。2023年公司营收5.2亿元,同比下滑...
2.23 MB共12页中文简体
1天前218积分
-
九号公司 多元业务助力成长,盈利上行通道开启 国金证券 2024-04-23(21页) 附下载

九号公司(689009)公司为全球智能短交通龙头,2015年收购全球平衡车鼻祖Segway,多年技术...
2.7 MB共21页中文简体
1天前218积分
-
珠海冠宇 消费类稳健增长,动力减亏可期 国金证券 2024-04-23(4页) 附下载

珠海冠宇(688772)2024年4月22日公司披露一季报,Q1实现营收25亿元,同增7%;实现归母...
917.78 KB共4页中文简体
1天前218积分
-
中宠股份 1Q业绩靓丽,期待自主品牌改革成效释放 国金证券 2024-04-23(4页) 附下载

中宠股份(002891)业绩简评4月22日公司披露23年业绩及24Q1季报,23年收入37.47亿元...
888.52 KB共4页中文简体
1天前218积分
-
昱能科技 微逆盈利承压,工商业储能贡献增长 国金证券 2024-04-23(4页) 附下载

昱能科技(688348)业绩简评4月22日公司披露2023年年报,2023年实现营收14.2亿元,同...
908.47 KB共4页中文简体
1天前218积分
-
阳光电源 Q1业绩超预期,海外储能业务多点开花 国金证券 2024-04-23(4页) 附下载

阳光电源(300274)业绩简评2024年4月22日,公司发布年报及一季报,2023年实现营收722...
1000.42 KB共4页中文简体
1天前218积分
-
苑东生物 精麻大单品筑底,创新+制剂国际化驱动长期成长 平安证券 2024-04-23(4页) 附下载

苑东生物(688513)事项:公司公布2023年年报,实现收入11.17亿元(-4.6%),归母净利...
728.65 KB共4页中文简体
1天前218积分
-
拓普集团 业绩稳健增长,多平台厚积薄发 国金证券 2024-04-23(4页) 附下载

拓普集团(601689)2024年4月22日公司披露年报,业绩基本符合业绩快报披露值。全年实现营收1...
950.89 KB共4页中文简体
1天前218积分
-
特宝生物 核心产品派格宾快速放量,公司业绩持续增长 国金证券 2024-04-23(4页) 附下载

特宝生物(688278)业绩简评2024年4月22日,公司发布2024年第一季度报告,2024年第一...
905.51 KB共4页中文简体
1天前218积分
-
神火股份 旺季铝板块有望量利齐升 国金证券 2024-04-23(4页) 附下载

神火股份(000933)事件4月22日,公司公布24年一季报,1Q24实现营收82.23亿元,环比-...
899.91 KB共4页中文简体
1天前218积分
-
上海家化 1Q24业绩超预期,期待战略转型&组织优化促持续提效 国金证券 2024-04-23(4页) 附下载

上海家化(600315)业绩简评公司4月22日公告1Q24营收19.05亿元、同比-3.8%,归母净...
907.11 KB共4页中文简体
1天前218积分




